INTRODUCCIÓN
La amiloidosis cardíaca por transtiretina (AC-TTR) es una miocardiopatía infiltrativa que se produce debido al depósito extracelular de proteína amiloide en el tejido cardíaco, que compromete su estructura, función ventricular y el strain longitudinal global (SLG). (1,2,3)
La AC-TTR es una enfermedad subdiagnosticada. No obstante, existen variables clínicas, electrocardiográficas y ecocardiográficas fácilmente accesibles en la práctica clínica habitual que pueden facilitar su detección temprana.
Anteriormente era considerada una enfermedad rara. El diagnóstico se realizaba de manera invasiva a través de la confirmación histológica. Sin embargo, en la última década ha habido un cambio de paradigma, impulsado por la aparición de tratamientos específicos, lo cual ha obligado a indagar sobre métodos diagnósticos no invasivos. (4)
Actualmente el centellograma cardíaco con fosfonatos es considerado una biopsia no invasiva debido a su alta sensibilidad y especificidad para el diagnóstico. Se lo combina con la determinación de cadenas livianas libres en sangre y orina, lo que permite excluir formas combinadas o alternativas de amiloidosis, en particular la amiloidosis por cadenas livianas (AC-AL).
La proteína amiloide posee alta afinidad por los trazadores con difosfonatos marcados con Tc99m. Los equipos con detectores de cadmio zinc telurio (CZT) permiten una evaluación de la distribución del hidroximetilendifosfonato (HMDP) debido a su alta resolución. (2,5)
Paralelamente, se ha postulado que el depósito amiloide puede afectar la microcirculación coronaria. La reserva de flujo miocárdico (RFM), entendida como la capacidad de la circulación coronaria para aumentar el flujo sanguíneo en respuesta a una demanda metabólica creciente, puede verse alterada por mecanismos relacionados con la infiltración amiloide. A medida que las proteínas amiloides se acumulan en las paredes de los vasos sanguíneos y el tejido cardíaco, su efecto vasoconstrictor y proinflamatorio puede comprometer la dilatación adecuada de la microcirculación, limitando la capacidad del corazón para adaptarse a las variaciones fisiológicas. (6, 7)
Las cámaras gamma con detectores CZT han surgido como una alternativa no invasiva y precisa para evaluar la RFM. Este método nos permite la adquisición de imágenes dinámicas con el fin de evaluar la respuesta vasodilatadora integrada del árbol coronario a través de la medición del flujo miocárdico y calcular la RFM. (8,9,10)
El objetivo primario de este trabajo es la evaluación de la RFM en pacientes con AC-TTR y como objetivo secundario, relacionar este parámetro con la distribución de amiloide cardiaco y el SLG.
MATERIAL Y MÉTODOS
Estudio unicéntrico, de cohorte única prospectiva.
Población
Se incluyeron en forma consecutiva 22 pacientes con ACTTR diagnosticados por centellograma cardíaco con HMDP con captación de grado 3 en la escala de Perugini y cadenas livianas en sangre y orina negativas. En todos los casos, el diagnóstico se estableció exclusivamente por métodos no invasivos, sin requerimiento de biopsia endomiocárdica.
Se excluyeron pacientes con enfermedad coronaria epicárdica conocida. Todos los participantes se encontraban sin tratamiento específico al momento de la evaluación.
Estudios de imágenes
Se realizaron ecocardiografía e imágenes de perfusión miocárdica (PM) convencionales y determinación de la RFM con MIBI Tc99m.
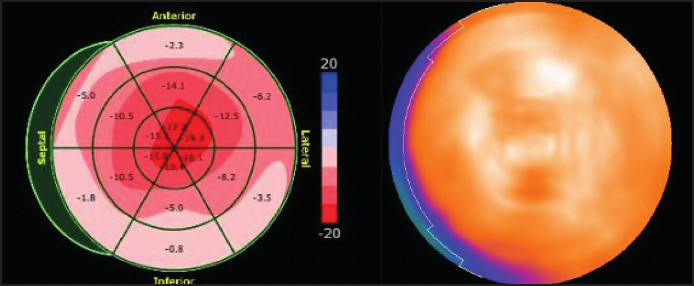
Las imágenes con difosfonatos se utilizaron para evaluar el grado de compromiso global del ventrículo izquierdo, expresado como porcentaje, así como la distribución territorial de sustancia amiloide. Esta cuantificación se realizó a través de mapas polares generados automáticamente por el software del sistema CZT. Los valores de captación se expresaron como porcentaje relativo de la actividad total en el ventrículo izquierdo, segmentados por territorio coronario. (Figura 1)
Fig. 1
Se observa en la imagen de la derecha un mapa polar que expresa la distribución del tejido amiloide. En las imágenes de la izquierda se muestran las imágenes tomográficas
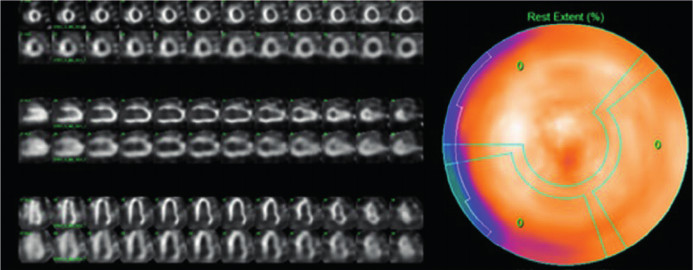
Fig. 2
Se observa centellograma cardíaco en vista anterior con un grado de captación 3 en la escala de Perugini
La centellografía se realizó una hora después de inyectar de forma endovenosa 20mCi de HDMP-Tc99m. Se adquirieron imágenes en una cámara ADAC doble cabezal bajo el siguiente protocolo: 1) Imágenes planares (anterior y oblicua anterior izquierda): Matrix 128×128 un millón de cuentas; 2) Imágenes tomográficas gatilladas de tomografía por emisión de fotón único (Gated SPECT por su denominación en inglés) (GATED SPECT): Matrix 64×64 con 30 segundos por cuadro. Las imágenes fueron procesadas con el software VEXWIN de Veccsa.
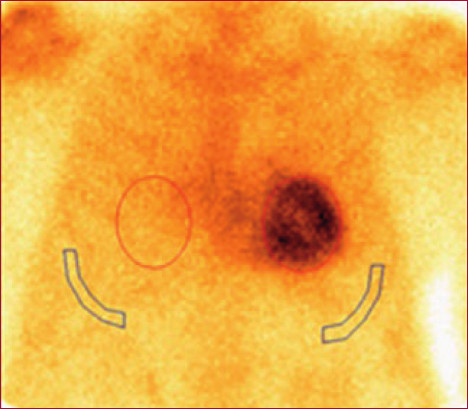
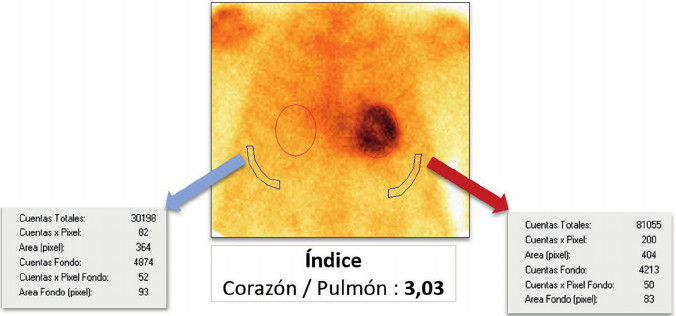
El informe fue realizado de forma independiente por dos cardiólogos con experiencia (AM, OM). Las discrepancias fueron resueltas por consenso. Se evaluó el grado de captación cardíaca en relación con el tejido óseo mediante dos métodos: A) Semicuantitativo, siguiendo la escala visual de Perugini (Figura 2), donde se comparó la captación cardíaca en relación con el esternón: grado 0 = captación ausente, I = captación cardíaca menor que el esternón, II = captación cardíaca similar que el esternón, III = captación cardíaca mayor que el esternón, y B) Cuantitativo: relación corazónpulmón definida como el número obtenido de dividir las cuentas a nivel de la silueta cardíaca y las cuentas en un área de igual tamaño situada contralateralmente. (11) (Figura 3)
Fig. 3
Se observa centellograma cardíaco en vista anterior con un ROI (región de interés) ubicado en la silueta cardiaca y otro en la región contralateral. El cálculo del índice corazón pulmón arroja un valor de 3,03
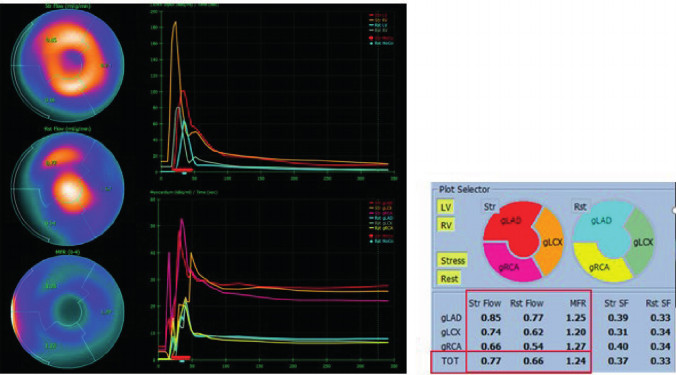
La RFM se determinó como la razón entre el flujo coronario absoluto (mL/min/g) durante la vasodilatación farmacológica inducida por dipiridamol y el flujo en reposo. Se considera normal un valor de flujo en estrés superior a 1,8 mL/min/g y una RFM ≥2. (12) (Figura 4)
Fig. 4
Se evidencia en la imagen de la izquierda las curvas del flujo miocárdico tanto en reposo como durante el apremio farmacológico con dipiridamol. En la imagen de la derecha podemos observar la cuantificación de los flujos, siendo el pico flujo con dipiridamol de 0,77 mL/min/g y en el reposo de 0,66 mL/min/g lo que determina un valor de RFM de 1,24 RFM; reserva de flujo miocárdico
A todos los pacientes se les realizó un estudio de perfusión miocárdica con valoración de la RFM con Tc99m-MIBI, mediante estrés farmacológico con dipiridamol y adquisición con CZT-SPECT en protocolo de un día, aproximadamente una semana después del centellograma cardíaco con HDMP. La medicación habitual no fue suspendida. Se indicó evitar el consumo de cafeína y de inhibidores de la bomba de protones al menos 24 horas antes del estudio. Además, se requirió un ayuno mínimo de dos horas previas al procedimiento.
Inicialmente se obtuvieron los valores hemodinámicos basales tras lo cual se inyectaron 7mCi de Tc99m-MIBI en reposo y se obtuvieron imágenes dinámicas para la determinación del FM basal, seguidas de las imágenes de PM convencionales. A los 60 minutos, se les administró 0,56 mg/kg de dipiridamol endovenoso en 4 minutos, seguidos de 21mCi de Tc99m-MIBI y se obtuvieron nuevamente los valores hemodinámicos e imágenes dinámicas para la determinación del FM tras el apremio.
Se realizó además un ecocardiograma Doppler color cardíaco con determinación de función ventricular y SGL. Se utilizó un ecocardiógrafo Philips Affinity C50. Los estudios fueron realizados por dos operadores (PE, MC) con transductor Matriz 5 MHz con adquisición de las imágenes bidimensionales con una tasa de cuadros entre 60 y 70 por segundo. La evaluación de los diámetros y espesores de las cavidades, área de aurícula izquierda, como así también de los flujos transvalvulares con las respectivas evaluaciones de función sistólica y diastólica, se realizaron de acuerdo con los lineamientos de la Sociedad Estadounidense de Ecocardiografía.(13) Además de la valoración ecocardiográfica convencional se analizó el SLG; el mismo fue adquirido a partir de las vistas apicales de cuatro, tres y dos cámaras. El procesamiento de las imágenes de strain 2D se efectuó de forma diferida en una estación de trabajo.
Análisis estadístico
Las variables categóricas se presentan como porcentajes y las variables continuas como medianas con su rango intercuartílico (RIC). La normalidad de las variables continuas fue evaluada mediante el test de Shapiro-Wilk. Dado que la variable RFM no presentó distribución normal (p < 0,05), las correlaciones entre los parámetros de interés se analizaron mediante el coeficiente de correlación de Spearman. Se consideró significativa una p < 0,05. Para los análisis se utilizó StatsDirect versión 3.3.5.
Consideraciones éticas
El estudio fue desarrollado según los principios de la Declaración de Helsinki (14) y aprobado por el comité de docencia e investigación de la institución y por un comité de ética independiente.
RESULTADOS
Se incluyeron 22 pacientes de sexo masculino con una edad promedio de 78 ± 7 años. Tenían antecedentes de hipertensión arterial 82 %, dislipidemia 73 %, diabetes 23 %, tabaquismo 59 %, insuficiencia cardíaca 68 % y fibrilación auricular 59 %.
El compromiso total de amiloide en el ventrículo izquierdo, evaluado mediante imágenes SPECT con reconstrucción en mapas polares, mostró una mediana de 88 % (RIC 81 %-97 %). La cuantificación territorial del depósito de TTR se realizó segmentando los mapas polares según la distribución estandarizada de los tres principales territorios coronarios. Se observó una mediana de captación de 94 % (RIC 91 %-100 %) en territorio de la descendente anterior, 94 % (RIC 91 %-98 %) en circunfleja, y 100 % en coronaria derecha.
El análisis de la fracción de eyección ventricular izquierda mostró por ecocardiografía una mediana de 56 % (RIC 45 %- 67,5 %) y por SPECT gatillado una de 52,5 % (RIC 39 %-57 %) sin diferencias estadísticamente significativas entre ambos métodos.
En cuanto al resultado del SLG arrojó una mediana de -8,16 (RIC-9,67 a -6,27).
En los estudios de perfusión miocárdica no se evidenció desarrollo de isquemia ni secuela de necrosis.
El estudio de la RFM reveló una mediana de 1,81 (RIC 1,33- 2,02) con un pico flujo en estrés de 1,22 mL/ min/g (RIC 0,95-1,74) y un valor de reposo de 0,77 mL/ min/g (RIC 0,64 - 0,91).
La Tabla 1 presenta los resultados individuales de flujo miocárdico en estrés y reposo (ml/min/g), la reserva de flujo miocárdico calculada como la razón entre ambos, la extensión total del depósito amiloide expresada en porcentaje y el SLG en los 22 pacientes con AC-TTR.
Tabla 1
Resultados individuales de flujo miocárdico en estrés y reposo (mL/min/g), reserva de flujo miocárdico (estrés/reposo), extensión total del depósito amiloide (%) y strain longitudinal global (SLG)
| Paciente | Estrés total | Reposo total | Reserva total | Extensión total | SLG |
|---|---|---|---|---|---|
| 1 | 2,29 | 0,88 | 2,62 | 78 | -8,54 |
| 2 | 0,95 | 0,55 | 1,83 | 93 | -6,27 |
| 3 | 1,23 | 0,65 | 1,82 | 88 | -5,74 |
| 4 | 1,65 | 0,83 | 1,89 | 84 | -9,6 |
| 5 | 0,61 | 0,33 | 1,88 | 99 | -6,46 |
| 6 | 0,82 | 0,64 | 1,33 | 96 | -2,87 |
| 7 | 0,79 | 0,50 | 1,71 | 68 | -6,2 |
| 8 | 0,95 | 0,64 | 1,47 | 77 | -6,23 |
| 9 | 2,12 | 1,13 | 1,80 | 80 | -9,67 |
| 10 | 1,99 | 0,74 | 2,61 | 92 | -5,48 |
| 11 | 1,18 | 0,90 | 1,30 | 82 | -7,06 |
| 12 | 1,35 | 0,67 | 2,06 | 99 | -8,33 |
| 13 | 1,12 | 0,86 | 1,31 | 100 | -6,41 |
| 14 | 0,77 | 0,66 | 1,24 | 97 | -8,65 |
| 15 | 1,74 | 0,75 | 2,41 | 100 | -12,3 |
| 16 | 1,74 | 1,08 | 1,61 | 88 | -9,67 |
| 17 | 1,16 | 0,91 | 1,23 | 84 | -12,98 |
| 18 | 1,95 | 0,92 | 2,02 | 91 | -6,41 |
| 19 | 1,22 | 0,94 | 1,30 | 81 | -6,4 |
| 20 | 1,41 | 0,80 | 1,82 | 81 | -11,75 |
| 21 | 1,62 | 0,97 | 1,67 | 85 | -12,96 |
| 22 | 1,21 | 0,46 | 2,81 | 100 | -9,69 |
No encontramos asociación entre la RFM, la extensión del depósito amiloide y el SLG, con valores de coeficiente de correlación de Spearman entre - 0,03 y 0,25, no significativos en ningún caso (Figura 5), ni una localización anatómica específica de los depósitos. (Figura 6).
Fig. 5
Mapas polares con los porcentajes de extensión de HMDP, con sus correspondientes valores de RFM, evidenciando que no hay correlación entre ambos parámetros
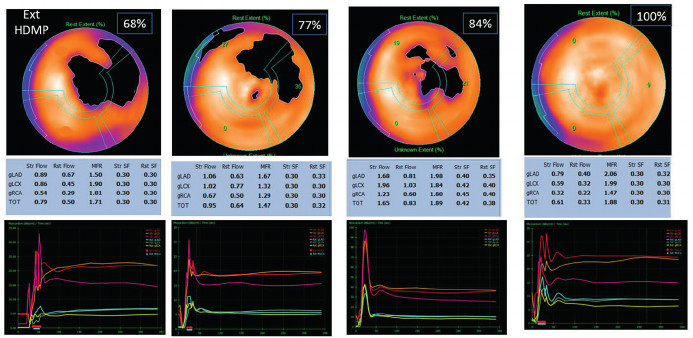
HDMP: hidroximetilendifosfonato; RFM: reserva de flujo miocárdico
DISCUSIÓN
En nuestro trabajo la mayoría de los pacientes con ACTTR presentaban disminución de la RFM con valores pico flujo anormales. No encontramos una correlación entre la RFM, la distribución de amiloide y el SLG.
El patrón característico del SLG en la amiloidosis cardíaca, descrito como “bandera de Japón”, se ha atribuido tradicionalmente a la acumulación predominante de depósitos de amiloide en las regiones basales y medias del ventrículo. No obstante, en nuestro estudio, observamos una distribución homogénea de los depósitos sin predilección específica por una localización determinada. (15)
En la literatura, no disponemos de estudios que evalúen la RFM mediante el uso de cámaras CZT. Aunque existen escasas investigaciones que abordan la RFM, estas se han llevado a cabo utilizando otros métodos; tomografía por emisión de positrones (PET), ecocardiograma, resonancia cardíaca. La mayoría de estos trabajos incluyen poblaciones heterogéneas, compuestas por pacientes con AC-TTR y con AC-AL, y algunos consisten únicamente en reportes de casos, lo que limita la extrapolación de sus hallazgos. (16,17,18,19,20)
Uno de los trabajos más relevantes que respaldan el rol de la disfunción microvascular en la AC es el estudio prospectivo de Dorbala et al., que incluyó una cohorte de 21 pacientes con diagnóstico confirmado, de los cuales 15 presentaban AC-AL y 6 AC-TTR, incluyendo las formas hereditaria y senil. Todos los pacientes estaban libres de enfermedad coronaria epicárdica significativa, y fueron comparados con un grupo control con hipertrofia ventricular izquierda de origen hipertensivo. Mediante PET con amonio N-13 y ecocardiografía, se evaluó la perfusión miocárdica en reposo y estrés, así como la RFM. Los hallazgos fueron consistentes: los pacientes con AC presentaron una reducción significativa del flujo miocárdico tanto en reposo como bajo estrés, una RFM marcadamente disminuida (1,19 vs. 2,23; p<0,0001) y un aumento de la resistencia vascular coronaria mínima. (20)
Un estudio de Clemmensen et al. evaluó específicamente la RFM en pacientes con AC en comparación con sujetos sanos. En esta cohorte prospectiva se incluyeron 27 pacientes con AC, 13 de ellos con AC- AL, 9 con AC-TTR de tipo hereditaria y 5 con AC-TTR tipo salvaje. Todos fueron sometidos a medición de la RFM mediante ecocardiografía Doppler transtorácica, evaluando el flujo en la arteria descendente anterior durante esfuerzo físico en posición semisupina. Los resultados mostraron una reducción marcada de la RFM en los pacientes con AC, con valores promedio de 1,7 en comparación con 3,9 en el grupo control (p<0,001). Esta alteración fue observada de forma consistente en las tres variantes de amiloidosis incluidas en el estudio, sin diferencias significativas entre ellas. (19)
Se postula que los mecanismos fisiopatológicos subyacentes de la disfunción microvascular en pacientes con AC podrían clasificarse en tres categorías principales: un mecanismo tóxico, en el cual la liberación de radicales libres inducida por la sustancia amiloide genera disfunción de la microcirculación; un mecanismo vascular, caracterizado por el depósito de amiloide en la pared de los vasos sanguíneos; y un mecanismo extravascular, asociado al depósito perivascular e intersticial de la sustancia amiloide. Si bien estos tres mecanismos pueden coexistir, los valores anormales de flujo pico observados en nuestra población sugieren un compromiso microvascular debido a compresión extrínseca, atribuida al depósito intersticial de proteína amiloide. (15,20,21)
En un estudio reciente que incluyó autopsias realizadas a pacientes con diagnóstico de AC, se analizó la distribución histopatológica de distintos tipos de amiloidosis. Los hallazgos revelaron que, en pacientes con AC por cadenas livianas, el patrón de depósito de fibrillas amiloides era predominantemente perivascular. En contraste, en pacientes con AC-TTR el patrón predominante era intersticial. Estos resultados refuerzan lo observado en nuestra población. (22)
El estudio de Mustafa Bulut et al. propone que la inflamación sistémica crónica es responsable de la disminución de la RFM en pacientes con amiloidosis sistémica. Para verificar esta hipótesis, se evaluó la RFM mediante ecocardiograma y se comparó con enfermedades sistémicas inflamatorias y con un grupo control sin enfermedad. Los resultados muestran que el subgrupo de pacientes con amiloidosis sistémica presentó valores de RFM significativamente más bajos que otros pacientes con enfermedades inflamatorias crónicas sin amiloidosis y que los individuos del grupo control. (23)
Los estudios publicados han documentado una disminución de la RFM en pacientes con amiloidosis cardíaca, asociándola con la presencia de síntomas anginosos. Se sugiere, incluso, que esta alteración podría constituir la primera manifestación clínica de la enfermedad. (16,18,24)
El surgimiento de distintas opciones terapéuticas específicas para la AC, muchas de las cuales aún se encuentran en fase de investigación, plantea nuevos desafíos en la práctica clínica. La identificación de los pacientes que más se beneficiarán del tratamiento, la elección del momento óptimo para iniciarlo y la selección del fármaco más adecuado, o incluso la posibilidad de combinarlos, dado que actúan sobre distintos mecanismos fisiopatológicos, son cuestiones clave que aún requieren mayor definición. En este contexto, la medición de la RFM podría representar una herramienta útil, al constituir un parámetro funcional que se ha asociado con el pronóstico y que podría contribuir a estratificar pacientes y guiar decisiones terapéuticas más personalizadas. (25,26,27)
Actualmente se está llevando a cabo un estudio prospectivo multicéntrico que evalúa la RFM mediante cámaras CZT en pacientes con diagnóstico de amiloidosis cardíaca por TTR vírgenes de tratamiento, con una medición basal y una reevaluación a los dos años de iniciado el tratamiento con tafamidis. Si bien sus resultados aún no han sido publicados, se espera que este estudio aporte información relevante para profundizar en los mecanismos fisiopatológicos involucrados y en la respuesta funcional al tratamiento específico, aspectos clave aún poco explorados en esta población. (28)
Nuestros hallazgos refuerzan la presencia de disfunción microvascular en pacientes con AC-TTR. La reducción de la RFM observada en nuestra población, asociada a una distribución homogénea del depósito amiloide y a un deterioro marcado del SLG, sugiere que el compromiso funcional del árbol coronario puede representar una manifestación precoz e independiente del grado de infiltración estructural. Si bien no se evidenció correlación entre la RFM y la cuantía de amiloide, esta observación plantea nuevos interrogantes fisiopatológicos y metodológicos que merecen ser explorados. El empleo de herramientas no invasivas, como las cámaras CZT, en combinación con técnicas más precisas de cuantificación tisular, podría abrir nuevas oportunidades para la estratificación de riesgo y monitoreo terapéutico en esta población.
CONCLUSIÓN
La RFM se encuentra comprometida en los pacientes con diagnóstico de AC-TTR con valores pico flujo anormales lo que sugiere compromiso microvascular debido al depósito intersticial de proteína amiloide. Sin embargo, no fue posible asociar en esta población el compromiso de la RFM con la cuantía de tejido amiloide.
No encontramos correlación entre la RFM, la distribución de amiloide cardíaco y el SLG.
La evaluación de la RFM se podría convertir en una herramienta, para comprender la progresión de la enfermedad y estratificar el riesgo en pacientes con AC-TTR.
Limitaciones
La población estudiada fue pequeña y se encontraba en estadios avanzados de la enfermedad.
Agradecimientos
El más sincero y profundo agradecimiento a todo el equipo técnico, cuyo invaluable aporte y dedicación constante han sido fundamentales para la realización de este trabajo. Sin su esfuerzo, este proyecto no hubiera sido posible.
Declaración de conflicto de Intereses
Los autores declaran que no tienen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la Web).